酵母表達系統是真核表達系統中應用最廣泛的之一,其中巴斯德畢赤酵母(Komagataella phaffii,又名Pichia pastoris)作為甲基營養型酵母的代表,近年來發展迅速,應用廣泛。
畢赤酵母:基因表達的新紀元
畢赤酵母表達系統誕生于上世紀80 年代初期,它融合了原核表達系統與真核表達系統的諸多優點,迅速在眾多表達系統中脫穎而出。與原核表達系統相比,它不僅保留了操作簡易、易于培養、生長速度快、表達量高、成本低等特性,還具備原核生物所欠缺的對外源蛋白的翻譯后修飾能力,如糖基化、蛋白磷酸化等,使表達的重組蛋白更接近天然產物。同時,它又克服了釀酒酵母分泌效率差、表達菌株不穩定、表達質粒易丟失等缺陷,成為外源蛋白表達的理想選擇。
畢赤酵母表達系統的主要優勢
1. 高效AOX1啟動子:目前最強、調控機制最嚴謹的啟動子之一,便于調控外源基因的表達。
2. 蛋白加工修飾功能:可對表達的外源蛋白進行糖基化、磷酸化、脂類酰化等翻譯后修飾,使重組蛋白與天然產物更相似。
3. 低成本與高效生長:菌株生長迅速,培養基成本低廉,培養條件簡單。
4. 高表達量:外源蛋白表達量高,支持胞內和分泌表達。
5. 基因穩定整合:外源基因能在基因組的特定位點以單拷貝或多拷貝形式穩定整合,可穩定遺傳50代以上。
6. 高密度發酵:耐受高密度發酵,便于工業化生產。
P. pastoris生產重組蛋白的流程
畢赤酵母菌株多樣性
當前所采用的巴斯德畢赤酵母菌株都源自原始的Y-11430菌,常用的有GS115、KM71、X33和SMD1168等。蛋白胞內表達優先選MutS表型,分泌表達Mut + 和MutS均可;多數菌株如SMD1168、GS115、KM-71是組氨酸脫氫酶缺陷型,可用不含組氨酸培養基篩選重組子,且SMD1168為蛋白酶缺陷型,適合表達不穩定蛋白質或蛋白質復合物以避免內源性蛋白酶降解。但SMD1168菌株生長緩慢,導致蛋白質產量低
|
菌株 |
基因型 |
表型 |
應用 |
|---|---|---|---|
|
X33 |
野生型 |
Mut+ His+ |
篩選Zeocin抗性表達載體 |
|
GS115 |
his4 |
Mut+ His- |
篩選含HIS4的表達載體 |
|
KM71 |
his4 arg4 aox1?::ARG4 |
MutS His- |
篩選含HIS4的表達載體 |
|
KM71H |
aox1::ARG4 arg4 |
MutS His+ |
篩選Zeocin抗生素抗性的表達載體 |
|
SMD1168 |
his4 pep4 |
Mut+ His+ |
在無蛋白酶A活性的酵母菌株中 篩選含HIS4的表達載體 |
|
SMD1168H |
pep4 |
Mut+ |
在無蛋白酶A活性的酵母菌株中篩選Zeocin抗生素表達載體 |
畢赤酵母常用表達載體
畢赤酵母表達載體分為分泌型和非分泌型兩大類,分別適用于不同類型的蛋白質生產需求,其中分泌型載體利用釀酒酵母的分泌信號序列,有效引導外源蛋白的分泌,提高了蛋白的產量和純度。因此,深入了解和優化畢赤酵母表達載體,對于提升蛋白生產效率和質量至關重要,也是當前生物技術和基因工程研究中的熱點之一。
|
表達載體 |
標志基因 |
菌株 |
重組蛋白 |
|---|---|---|---|
|
pPIC9K |
His4, Kan, Amp |
GS115 |
Xylanase |
|
GS115 |
Porcine circovirus type 2 |
||
|
GS115 |
Endo‐1,3(4)‐b‐d‐glucanase |
||
|
GS115 |
Staphylokinase |
||
|
pPICZα |
Shble |
SMD1168 |
Human chitinase |
|
GS115 |
Human topoisomerase I |
||
|
GS115 |
Human interferon gamma |
||
|
X‐33 |
C‐reactive protein |
||
|
SuperMan5 |
Insulin |
||
|
X‐33 |
Human RNase4 |
||
|
pHIL‐S1 |
His4, Amp |
GS115 |
Rabies virus glycoprotein |
|
GS115 |
Rhizopus oryzae Lipase |
||
|
KM71 |
Camel lactoferricin |
||
|
pGAPZα |
Shble |
GS115 |
Acyl homoserine lactonase |
|
SMD1168 |
Variable lymphocyte receptor B |
||
|
X‐33 |
Human gastric lipase |
||
|
pJL‐SX |
FLD1, Amp |
MS105 |
Formaldehyde dehydrogenase |
|
pBLHIS‐SX |
His4, Amp |
JC100 |
Leukocyte protease inhibitor |
常見的用于生產分泌蛋白的畢赤酵母表達載體【1】
|
表達載體 |
標志基因 |
菌株 |
重組蛋白 |
|---|---|---|---|
|
pPIC3.5K |
His4, Kan, Amp |
KM71 |
Maltooligosyltrehalose synthase |
|
SMD1168 |
Camellia sinensis heat shock protein |
||
|
GS115 |
Pleurotus ostreatus laccases |
||
|
GS115 |
Rhizopus oryzae Lipase |
||
|
GS115 |
HSA/GH fusion protein |
||
|
pPICZ |
Shble |
X‐33 |
Aquaporin |
|
KM71 |
Membrane protein |
||
|
KM71 |
Dengue virus envelope glycoprotein |
||
|
pHIL‐D2 |
His4, Amp |
GS115 |
Prostaglandin H synthase‐2 |
|
GS115 |
CatA1 and SODC |
||
|
KM71 |
Rhodococcus nitrile hydratase |
||
|
GS115 |
Feline serum albumin |
||
|
pGAPZ |
GS115 |
GTPase RabA4c |
|
|
GS115 |
Xylose isomerase |
||
|
GS115 |
β‐Galactosidase |
||
|
pJL‐IX |
FLD1, Amp |
MS105 |
Formaldehyde dehydrogenase |
|
pBLHIS‐IX |
His4, Amp |
KM71 |
L1‐L2 proteins of HPV virus type 16 |
常見的用于生產胞內蛋白的畢赤酵母表達載體【1】
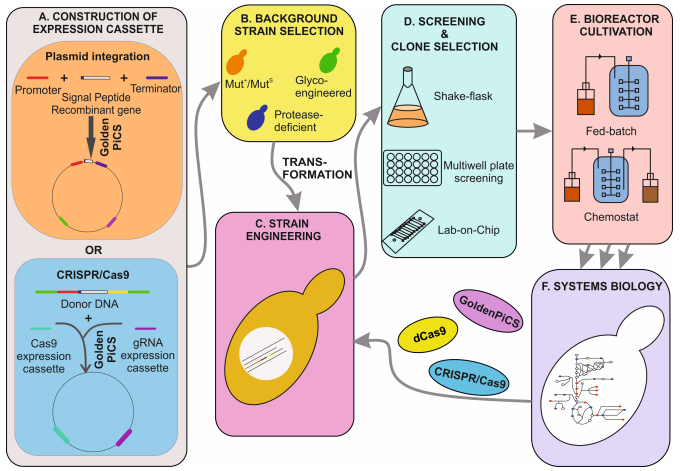
畢赤酵母基因改造技術
1. 基于線性化質粒載體的同源重組
同源重組技術是一種利用生物體自身修復機制的基因工程技術。在畢赤酵母中,通過將線性化的質粒載體引入,可以高效地將外源基因整合到宿主基因組的特定位點。這一過程依賴于同源臂序列,這些序列與目標基因組區域具有高度相似性,從而促進了質粒載體與宿主DNA之間的重組。這種方法的優勢在于其操作簡便、整合效率高,可以實現外源基因的多拷貝插入,這對于提高基因表達水平和蛋白質產量至關重要。在工業生產中,這種技術常被用于優化基因表達,以滿足生物制藥和工業酶生產的需求。此外,同源重組技術還可以用于基因功能研究、疾病模型構建以及生物技術產品的開發。
2. 基于CRISPR/Cas9的基因編輯
CRISPR/Cas9系統是一種革命性的基因編輯技術,它通過利用指導RNA(gRNA)引導核酸酶Cas9精確切割目標DNA序列。這種特異性的切割觸發了細胞內的修復機制,包括非同源末端連接(NHEJ)和同源定向修復(HDR),從而實現基因的敲除、插入或替換。CRISPR/Cas9技術以其高效性和精準性在基因組編輯領域占據重要地位,特別適用于復雜代謝途徑的優化和多基因編輯。在畢赤酵母中,CRISPR/Cas9技術已被廣泛應用于基因功能研究、菌株改良以及生產性能的提升。例如,通過敲除或替換特定基因,可以增強宿主菌的蛋白質表達能力或改變其代謝特性,以適應特定的工業生產需求。
3. 基于CRISPR/Cas12的基因編輯
CRISPR/Cas12系統,也稱為Cpf1,是CRISPR家族中的另一種基因編輯工具。Cas12蛋白具有廣泛的靶向能力和單鏈DNA切割特性,使其在基因組編輯中具有獨特的優勢。與Cas9相比,Cas12對靶位點的PAM(原始間隔短回文重復序列)依賴性更寬松,這為基因編輯提供了更大的靈活性。CRISPR/Cas12系統在表觀遺傳調控和新型生物技術的開發中展現出巨大潛力,例如,它可以用于研究基因沉默、激活以及DNA甲基化等表觀遺傳修飾。此外,Cas12的單鏈切割特性使其在開發新型核酸檢測技術、基因治療策略以及合成生物學應用中具有獨特的應用前景。在畢赤酵母中,CRISPR/Cas12技術的應用還相對較新,但已有研究表明,它在基因組編輯和基因功能研究中具有巨大的潛力。
畢赤酵母創新突破
經過幾十年的廣泛應用,畢赤酵母表達系統已成功表達了數以千計的異源蛋白,其中大部分為醫藥制品。美國FDA 對該系統的認可,如 Cephelon 制劑的獲批,充分證明了其安全性和有效性。在我國,雖然目前上市的基因工程藥物大多源于大腸桿菌原核表達系統,但畢赤酵母表達系統憑借其國際上的廣泛認可,必將在未來的醫藥市場中占據重要地位。
泓迅生物
泓迅生物利用CRISPR等新技術,實現了對畢赤酵母基因組的精準編輯,包括基因敲除、插入和替換。我們成功敲除了GS115菌株的KU70基因,顯著提高了畢赤酵母的重組效率和外源基因的整合頻率,同時敲除了pep4基因,降低了外源蛋白被降解的風險。
我們深耕合成生物學領域,擁有豐富的基因合成、重組蛋白表達和基因編輯經驗。我們提供一站式解決方案,幫助解決畢赤酵母蛋白表達和基因改造的需求,最大限度縮短研發周期。
》案例展示
通過對畢赤酵母GS115的基因改造,提高了菌株對外源蛋白的表達和分泌。并利用該重組菌株成功表達了多個人源重組蛋白的高效分泌表達,培養液中雜蛋白很少,產量預計可達10g/L。

》免費樣品測試
· 可免費提供少量蛋白樣品以供測試。
· 菌株、蛋白等相關信息可聯系本司咨詢。

填寫申請
未來展望
畢赤酵母表達系統以其高表達、高密度、多樣化翻譯后修飾以及無內毒素和病毒的安全性等優勢,成為重組蛋白表達的優選平臺。CRISPR/Cas9等基因組編輯技術的應用將進一步推動該系統的發展,助力重組人源蛋白在生物醫藥、美容護膚等領域的研究和應用。
重組膠原蛋白基因的選擇和設計、表達條件的優化和驗證對于獲得高產量的蛋白至關重要。泓迅生物提供從“序列優化”到“基因合成”到“重組膠原蛋白表達”一站式服務。高效的基因合成、多種表達體系協助您在實驗室低成本無限合成,提高膠原蛋白的表達量、親水性和可加工性,創造更多應用可能。
參考文獻
[1] Karbalaei M, Rezaee S A, Farsiani H. Pichia pastoris: A highly successful expression system for optimal synthesis of heterologous proteins[J]. Journal of cellular physiology, 2020, 235(9): 5867-5881.
[2] De S, Mattanovich D, Ferrer P, Gasser B. Established tools and emerging trends for the production of recombinant proteins and metabolites in Pichia pastoris. Essays Biochem. 2021 Jul 26;65(2):293-307.
[3] Cos, O. et al. (2006). Microbial Cell Factories, 5, 1-20.
[4] Staley, C. A. et al. (2012). Gene, 496(2), 118-127.
[5]覃曉琳et al. (2010).生物技術, 20(3), 4.
[6]周則迅&袁漢英. (2000).復旦學報:自然科學版(3), 264-268.
[7] Siegel, R. S. & Brierley, R. A. (1989). Biotechnology and bioengineering, 34(3), 403-404.
[8] Liu, Q. et al. (2019). Microbial cell factories, 18, 1-11.
 Syno?C 引物合成
Syno?C 引物合成 RNA合成
RNA合成 mRNA合成
mRNA合成 Syno?GS 基因合成
Syno?GS 基因合成 載體構建
載體構建 高通量及DNA文庫構建
高通量及DNA文庫構建 CRISPR基因編輯平臺
CRISPR基因編輯平臺 病毒包裝
病毒包裝 基因測序及分析
基因測序及分析 重組蛋白表達平臺
重組蛋白表達平臺 抗體工程平臺
抗體工程平臺 多肽服務
多肽服務 生物信息學分析與設計
生物信息學分析與設計 CRISPR文庫
CRISPR文庫 ProXpress蛋白快速檢測
ProXpress蛋白快速檢測 CRISPR 質粒
CRISPR 質粒





















